Построение калибровочного графика. В мерные колбы вместимостью 50 см3 при помощи бюретки вносят 0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0 и 3,0 см3 рабочего раствора
В мерные колбы вместимостью 50 см3 при помощи бюретки вносят 0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0 и 3,0 см3 рабочего раствора, что соответствует 0; 0,1; 0,2; 0,5; 1,0; 1,5 2,0 и 3,0 мг/дм3 ионов аммония. Объем каждой колбы доводят до метки безаммиачной водой и перемешивают раствор.
Определение оптической плотности (абсорбционности) начинают с раствора, имеющего наибольшую концентрацию. Для этого к полученным растворам прибавляют по 1 см3 сегнетовой соли и 1 см3 реактива Несслера, перемешивают и через 10 мин измеряют абсорбционность всех растворов на КФК-2 относительно раствора сравнения, не содержащего (0 мг/дм3) ионов аммония. Измерения проводят при длине волны 400 нм в кювете с толщиной поглощающего слоя 30 мм. Результаты измерения заносят в табл. 20. По полученным данным строят калибровочный график А = f(С).
Таблица 20
Построение калибровочного графика
| № п/п | |||||||||
| Объем рабочего раствора Vр, см3 | 0,1 | 0,2 | 0,5 | 1,0 | 1,5 | 2,0 | 3,0 | ||
| Концентрация ионов аммония в мерной колбе CNH4+, мг/дм3 | 0,1 | 0,2 | 0,5 | 1,0 | 1,5 | 2,0 | 3,0 | ||
| Светопропускание Т | |||||||||
| Ср | |||||||||
| Абсорбционность А |
Проведение анализа
В мерную колбу вместимостью 50 см3 отбирают 50 см3 (или меньший объем) тщательно перемешанной исследуемой воды и доводят раствор до метки дистиллированной водой, затем поступают так же, как и при построении калибровочного графика.
По калибровочному графику находят содержание азота аммонийных солей Сх , мг/дм3, в исследуемых водах.
Обработка результатов
Содержание ионов аммония X, мг/дм3, в воде вычисляют по формуле
Х = 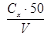 ,
,
где Сx – содержание NH4+, найденное по калибровочному графику, мг/дм3; 50 – объем стандартного раствора, см3; V – объем пробы, взятый для анализа, см3.
Результаты расчетов заносят в табл. 21.
Таблица 21
Экспериментальные и расчетные данные
| Вода | Объем исследуемой воды V, см3 | Свето-пропус- кание Т | Абсорб-ционность А | Концентрация ионов аммония, найденная по калибровочному графику, Сх, мг/дм3 | Содержание ионов аммония в исследуемой воде Х, мг/дм3 |
| Водопроводная | |||||
| Талая | |||||
| Техническая | |||||
Р а б о т а 16
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА (III)
В ВОДНЫХ РАСТВОРАХ
1. Цель работы: получить общие сведения о фотоколориметрическом методе анализа; практически ознакомиться с фотоколориметрическим методом определения железа; определить содержание ионов железа в исследуемых водах; провести сравнение с ПДК.
Сущность метода
В подземных водах железо находится в форме гидрокарбоната железа (II). При попадании в открытые водоемы гидрокарбонаты теряют СО2 , а карбонат гидролизуется с образованием гидроксида железа (II), который, реагируя с О2 , растворенным в воде, образует гидроксид железа (III) и затем переходит в оксид железа (III).
Fe(HCO3)2 = FeCO3 + H2O + CO2
FeCO3 + H2O = Fe(OH)2 + CO2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 = 2Fe2O3 · 3H2O
Таким образом, в воде могут находиться соединения железа (II) и (III).
Большие количества растворенного в воде железа не оказывают вредного влияния на здоровье людей, но такая вода не пригодна для хозяйственно-бытовых целей.
Повышенное содержание железа вызывает окрашивание, помутнение воды, а также придает воде запах сероводорода и неприятный привкус. Вода с повышенным содержанием железа не пригодна для использования в ряде отраслей промышленности.
ГОСТ 2874-82 устанавливает для воды водопроводов ПДК железа, равную 0,3 мг/дм3, для воды местных источников водоснабжения допускается содержание железа 0,5-0,6 мг/дм3. Для водопроводов, подающих воду без специальной обработки, – по согласованию с СЭС до 1 мг/дм3.
Определение железа основано на получении комплексного соединения тиоцианата железа (III), интенсивность окраски которого находится в прямой зависимости от концентрации железа (III). Катион железа (III) с тиоцианат ионами NCS– в зависимости от концентрации NCS– образует ряд комплексов кроваво-красного цвета, обусловливающих различную интенсивность окрашенного раствора. Например. При концентрации NCS–-ионов, равной 5.10-3 моль/дм3, образуется комплексный ион:
Fe+3 + NCS– = [Fe(NCS)] 2+;
при концентрации NCS– 1,2 . 10-2 моль/дм3
Fe+3 + 2NCS– = [Fe(NCS)] +;
при концентрации NCS– 4 . 10-2 моль/дм3
Fe+3 + 3NCS– = [Fe(NCS)3];
при концентрации NCS– 1,6 . 10-1 моль/дм3
Fe+3 + 4NCS– = [Fe(NCS)4] -;
при концентрации NCS– 7 . 10-1 моль/дм3
Fe+3 + 6NCS– = [Fe(NCS)] 2–.
Число координированных групп NCS– в комплексе может достигать шести:
Fe+3 + 6NCS– = [Fe(NCS)6] 2–
Чтобы подавить гидролиз соли железа, растворы подкисляют разбавленной азотной кислотой; серная и особенно хлороводородная кислоты ослабляют окраску растворов и менее пригодны для подкисления.
Растворы тиоцианата железа при стоянии медленно обесцвечиваются, так как тиоцианат восстанавливает железо (III), поэтому рекомендуется прибавлять к раствору небольшое количество персульфата калия (аммония), что препятствует восстановлению железа (III) тиоцианатом. Поскольку окраска тиоцианата железа быстро изменяется, проводить анализ надо сразу и по возможности быстро.
Приборы и реактивы
1) ФотоколориметрФК-120; 2) посуда стеклянная: бюретка вместимостью 25 см3, мерные колбы вместимостью 50 и 100 см3; пипетки Мора вместимостью 1 и 50 см3,градуированные пипетки вместимостью 1 и 10 см3, кюветы с толщиной поглощающего слоя 30 мм; 3) растворы: азотная кислота (1:1); серная кислота, концентрированная H2SO4 (r = 1,84 г/см3); тиоцианат аммония NH4NCS (или KNCS) с массовой долей растворенного вещества w (NH4NCS; KNCS) = 50 %; стандартный раствор железоаммонийных квасцов (раствор 1), рабочий раствор железоаммонийных квасцов (раствор 2), персульфат калия (аммония) кристаллический.
Алгоритм определения
