Энтропия және термодинамиканың екінші заңы
Бірінші заңның негізгі функциясы - ішкі энергия. Оқшауланған жүйелердің ішкі энергиясы өзгермейді. Бұл бірінші заңның анықтамаларының бірі. Бірінші заң процестің өту-өтпеуін, оның бағытын және шегін көрсетпейді. Бұл сұрақтарға термодинамиканың екінші заңы жауап береді.
Екінші занңың негізгі функциясы - энтропия. Негізінен энтропия арқылы жоғарыдағы мәселелер шешіледі. Энтропия ұғымы арқылы екінші заңға тағы бір анықтама беруге болады: энтропия - жүйенің біртекті күй функциясы. Бұл анықтама бірінші және екінші заңның формальді түрде ұқсастығын көрсетеді, яғни бірінші занда күй функциясы ретінде ішкі энергия алынса, екінші заңда энтропия алынады.
Сонымен қатар бірінші заңнын негізгі теңдеуінде  Q=dU+
Q=dU+  A ішкі энергияның аз өзгеріске ұшыраған мөлшері толық дифференциал күйінде алынса, екінші заңның тендеуіндегі энтропияның өзгерісі де толық дифференциал болады (dS=
A ішкі энергияның аз өзгеріске ұшыраған мөлшері толық дифференциал күйінде алынса, екінші заңның тендеуіндегі энтропияның өзгерісі де толық дифференциал болады (dS= 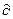 Q / Т). Энтропия -жүйе күй функциясы, оның қасиеті, олай болса энтропияның өзгерісі процестің өту жолына тәуелсіз, тек алғашқы және соңғы күйіне байланысты.
Q / Т). Энтропия -жүйе күй функциясы, оның қасиеті, олай болса энтропияның өзгерісі процестің өту жолына тәуелсіз, тек алғашқы және соңғы күйіне байланысты.
Жүйе қасиеті интенсивті және экстенсивті болып екі топқа бөлінетінін білеміз. Энтропия экстенсивті қасиетке жатады, демек ол қосылатын шама. Бұл (IV.8)-теңдеуден түсінікті. Ол Карно циклінде өтетін қайтымды процесс үшін табылған тендеу. Оны түрлендіріп жазсақ:
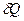 қайтымды = TdS
қайтымды = TdS
Мұндағы сол жақтағы шама жылу энергиясының аз мөлшердегі өзгерісі, олай болса оң жақтағы көбейтіндінің өлшемі де энергия өлшемімен алынады. Энергия екі түрлі қасиеттердің көбейтіндісі екенін білеміз, олар интенсивті және экстенсивгі қасиеттер. Яғни берілген көбейтіндіде абсолюттік температура - интенсивті қасиет болса, ал энтропия - экстенсивті қасиет.
Энтропия аддитивті заңдарға бағынады, демек тепе-тендіктегі жүйенің энтропиясы оның барлық бөліктер энтропияларының қосындысына тең, ал энтропия өзгерісі сол бөліктердегі энтропия өзгерістерінің қосындысына тең. (ІV.8) - теңдеу Карно циклінде - идеал газ үшін алынған. Ал Карно-Клаузиус теоремасы бойынша жұмыскер дененің табиғаты циклді процестердің нәтижесіне әсер етпейді. Сондықтан (IV.8)-теңдеуді кез - келген жүйеге қолдануға болады. Тек бұл жүйеде қайтымды ғана процестер жүруге тиісті. Сөйтіп
dS=(  Qқайтымды )/ Т ; TdS=
Qқайтымды )/ Т ; TdS=  Qқайтымды (IV. 10)
Qқайтымды (IV. 10)
тендеулер қайтымды процестер үшін екінші заңның математика тіліндегі анықтамасы. Қайтымды процестер оқшауланған жүйеде өтетін болса:
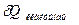 0, онда = dS=0 (IV.1O a)
0, онда = dS=0 (IV.1O a)
Жүйенің күйі шекті мәнге өзгеретін болса, (IV.10)-теңдеуден:
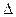 S=S2-S1=fdS=f
S=S2-S1=fdS=f  Qқайтымды T (IV.11)
Qқайтымды T (IV.11)
Айналмалы процестер үшін энтропияның өзгерісі: fdS=0 (IV. 11 а), демек энтропияның өзгерісі нольге тең болады. Қайтымды процестер үшін екінші заң энтропияның болу және сақталуы туралы: заң болып шығады. Қайтымды процестер оқшауланған жүйеде өтетін болса (IV.10а)-тендеу бойынша энтропия өзгермейді. Егер қайтымды процесс оқшауланбаған жүйеде өтетін болса, оның энтропиясы өзгереді, бірақ мұндайда айлаладағы ортаның да энтропиясы өзгеруге тиісті. Осындай жағдайда процеске катысатын денелер энропияларының қосындысы тұрақты болады.
Термодинамиканың екінші заңын қайтымсыз процестер үшін математика тілінде жазып көрейік. 1 күйден 2 күйге жүйе қайтымды (15-сурет, в) және қайтымсыз процестер арқылы (15-сурет, а) өтті дейік. Онда бұл екі процесс үшін бірінші заңның теңдеуін жазатын болсақ, төменгі екі теңдеуді 15-сурет аламыз:
 Qқайтымсыз = dU+
Qқайтымсыз = dU+  Ақайтымсыз (IV. 12)
Ақайтымсыз (IV. 12)
 Qқайтымды = dU+
Qқайтымды = dU+  Ақайтымды (IV. 13)
Ақайтымды (IV. 13)
Осы тендеулерді бір-бірінен шегергенде төмеңдегіні аламыз:
 Qқайтымсыз-
Qқайтымсыз- 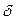 қайтымды = dU+
қайтымды = dU+  Ақайтымды (IV. 13а)
Ақайтымды (IV. 13а)
Бұл теңдік айналмалы процесс үшін орындалады (15-сурет). (IV.13а)-өрнек не нольге тең, не нольден үлкен, не кіші болуы мүмкін.
Егер процестің екеуі де (тура және кері процесс) қайтымды болса, (IV.13а)-теңдеу нольге тең болады, себебі қайтымды процесс тура және кері жүргізілгенде жүйеде және айналадағы ортада ешқандай өзгерістер болмайды.
(IV. 13а) - теңдеудің екі жағы да нольден үлкен болса, онда келтірілген айналмалы процестің нәтижесінде жылу сырттан
сіңіріліп эквивалент мөлшерде жұмыс жасалды, демек жылу жұмысқа толық айналды. Бұл екінші заңға қайшы келеді. себебі жылу толығымен жұмысқа айналмайды, бір белігі компенсация түрінде жоғалады (Томсонның анықтамасы). Егер (IV.13а) - теңдеудің екі жағындағы айырымдары нольден кіші болса, бұл екінші заңға қайшы болмайды, себебі бұл жерде жұмыс түгелдей жылуға айналады. Ол жұмыс пен жылудың табиғатына байланысты.
Сөйтіп қайтымсыз процесті төменгі теңсіздіктер белгілейді:
 Qқайтымсыз <
Qқайтымсыз < 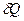 қайтымды (IV. 14)
қайтымды (IV. 14)
 Ақайтымсыз <
Ақайтымсыз <  Ақайтымды
Ақайтымды
Қайтымды процестегі жұмысты максималды дейміз, себебі қайтымсьтз процестегі жұмыспен салыстырғанда оның мөлшері артық болады. Сонда былай жазуға болады:
 Ақайтымды =
Ақайтымды =  Аmax ; Ақайтымды = Аmax (IV. 15)
Аmax ; Ақайтымды = Аmax (IV. 15)
Қайтымсыз процестегі жылу мен энтропияның арасындағы қатынастарды қарастырайық. (ІV.14-теңдеулерді ескеретін болсақ қайтымсыз процестегі жылу қайтымдыдағы жылудан кем болады. Сонда (IV.8)-теңдеуді есепке алсақ, теңсіздік белгісі пайда болады:
dS > (  Qқайтымсыз ) / Т, немесе
Qқайтымсыз ) / Т, немесе
TdS >  Qқайтымсыз
Qқайтымсыз  (IV. 16)
(IV. 16)
Мұны 1 және 2-күйдің аралығында алсақ:
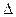 S=S2-S1 =
S=S2-S1 = 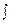 dS>(
dS>( 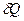 қайтымсыз) /Т (IV. 17)
қайтымсыз) /Т (IV. 17)
Оқшауланған жүйеде қайтымсыз процесс өткенде  Qқайтымсыз ,
Qқайтымсыз ,
сонда (ІV.16)-теңдеуден
dS>0 (IV І7 a)
Қайтымсыз процестері бар циклдерде (IV.17а) мен (IV. 16)
теңдеулерді біріктіріп қарастырғанда:
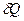 қайтымсыз / Т<0 (IV 18)
қайтымсыз / Т<0 (IV 18)
(IV. 16) мен (IV.Ш - тендеулер екінші заңның кайтымсыз процестерін сипаттайды. Қайтымсыз процестер үшін екінші заңды энтропияның болуы мен оның өсуі деп түсінуге болады. (IV..17a) теңдеу оқшауланған жүйеде қайтымсыз процесс өткенде оның энтропиясы өседі деп табады.
Қайтымды және қайтымсыз процестерді біріктіріп карастырсақ термодинамиканың екінші заңы былай жазылады:
dS 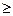
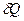 /T (IV 19)
/T (IV 19)
немесе TdS 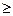
 Q (IV 20)
Q (IV 20)
Мұнда теңдік белгісі кайтьімды, ал теңсіздік белгісі қайтымсыз процестерді көрсетеді. Оқшауланған жүйеде 6Q=0, сонда (ІУ.19)-теңдеуді алсақ:
dS 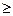 0,
0, 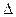 S
S 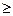 0 (IV. 21)
0 (IV. 21)
Бірінші және екінші заңының теңдеулерін біріктіріп жазатын болсақ, (ІІ.9) және (IV.20)-тендеулер)
TdS>dU+  A (IV.22)
A (IV.22)
Бұл термодинамиканың бірінші және екінші заңының жалпы теңдеуі.
Егер жүйеде шексіз аз мөлшерде қайтымсыз процесс өтетін болса, энтропиясы өзгеруі мүмкін. Біріншіден, айналадағы ортадан жылу ауысқанда энтропия өзгереді (dSe), екіншіден, жүйенің өзінде қайтымсыз процестің өтуіне байланысты энтропия өзгереді (dSi). Сонда жалпы энтропияның өзгерісі
dS-dSe+dSt
Қайтымды процестер үшін dSi=0. (IV.22) -теңдеуден жұмыстың аз мөлшердегі өзгерісін есептесек:
 A
A 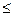 TdS-dU (IV.22a)
TdS-dU (IV.22a)
Бұл теңдеу жоғарыда қайтымды процестің жұмысы максимал, ал қайтымсыз процестікі одан аз болады деп айтылғанды көрсетеді.
Адиабаталық процестерде жүйеге сырттан жылу берілмейді, яғни  Q=0, T
Q=0, T  dS=0, демек, S=const, мұндай процесті изоэнтропиялық процесс деуге болады. Бұл жағдайда (ІУ.22а) - өрнекті қайтымды процестер үшін теңдік түрінде алатын болсақ:
dS=0, демек, S=const, мұндай процесті изоэнтропиялық процесс деуге болады. Бұл жағдайда (ІУ.22а) - өрнекті қайтымды процестер үшін теңдік түрінде алатын болсақ:
6A=-dU (IV.23)
Ішкі энергияның аз мөлшердегі өзгерісі дифференциал түрінде алынады, оның себебі ішкі энергия - жүйенің қасиеті. Сонда (ІV.23)-теңдеуден қайтымды процестер үшін жұмыстың аз мөлшердегі өзгерісі толық дифференциал болып алынады:
d A=-dU (IV. 23 a)
Мұны интегралдағанда:
A2-A1= 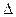 A=U2-U1
A=U2-U1
Қайтымды процестің жұмысын максималды десек
Amax=U2—U1
Ал жалпы алганда қайтымды процесс үшін:
dAmax=TdS—dU
Осы теңдеуді тұрақты температурада интегралдау арқылы максимал жұмыстың мәнін табады:
Amax = T(S2-S1)-(U2-U1)
немесе
Amax=(U1-TS1)-(U2-TS2) (IV.24)
Екінші заң негізінде жылу машиналарын қарастырудан шыққан. Бірақ бұны тек жылу машиналарына қолданылатын заң деп түсінбеу керек. Бұл табиғат зандарының бірі болып табылады. Екінші заңды жылу машиналарсыз, басқа жолдармен де қорытып шығаруға болады.
Мұны адиабаталық процестерді тексеру арқылы Каратеодори көрсеткен. Каратеодори 1909 ж. өзінің принципін ұсынды: адиабаттық процестер арқылы жүйенің кейбір көршілес күйіне жетуге болмайды.
Термодинамиканың бірінші және екінші зандарының жалпы теңдеуі қайтымды процестер үшін:
TdS=dU+  A
A
Егер процестің нәтижесіңде тек ұлғаю жұмысы жасалса:
TdS=dU+PdV
немесе
dS=(1 / T)dU+(1 / T)PdV (ІV.25)
Бұнда dU - ішкі энергияның толық дифференциалы, ол көлем мен температураға тәуелді күй функциясы, яғни U=f(T,V). Оны туындылар арқылы жазатын болсақ, (ІV.25)-теңдеу төмендегідей болады:
dS=1 / T( 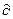 U/
U/ 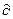 T)vdT+1 /T[(
T)vdT+1 /T[( 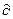 U/
U/ 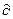 V)T+P
V)T+P 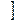 dV (1V.26)
dV (1V.26)
Адиабаталық процестер үшін  Q=0, сонда (ІV.26)-теңдеу Пфафф теңдеуіне айналады:
Q=0, сонда (ІV.26)-теңдеу Пфафф теңдеуіне айналады:
1/T( 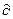 U/
U/ 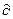 T)vdT+1/T[(
T)vdT+1/T[( 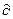 U/
U/ 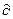 V)T+P]dV=0 (IV.27)
V)T+P]dV=0 (IV.27)
демек график түрінде мұны көрсететін болсақ Т мен V аралығындағы байланыстар бірнеше адиабата қисықтары арқылы алынады (16-сурет).
Бұл адиабаталар бір-бірімен қиылыспайды. 16-суретте S1 адиабатадағы а күйден S2 - адиабатадағы b күйге адиабаталық жағдайда ауысуға болмайды, яғни аb сызық адиабата болмайды. Осыдан Каратеодори принципі шығады. Ол принцип бойынша жүйенің термодинамикалық күйлердің кейбіреуіне адиабаталық процестер арқылы жетуге болмайды. Осындай принциптің орылдалуы (IV.26) - теңдеуді Пфафф теңдеуіне айналдырады, яғни бұл жерде 1 / Т интегралдау көбейткішті қолданамыз. Сөйтіп S жаңа күй функциясы - энтропия осы интегралдау көбейткіші арқылы табылды. Мысалы, жүйе 1 күйден 2 күйге жылу сіңірілу арқылы ауысты дейік (17-сурет). Ал кері 2 күйден 1 күйге жүйені жылу алмаспай жүргізуге бола ма? Жылу - жүйенің күй функциясы емес, ол энергия алмасу формасы, егер бұл жүйеге жылу беріп оның күйін өзгертсек (1-2), ол жылуды эквивалентті жұмыс арқылы анық, жүйені 1-күйге қайтадан оралтуға бола ма? Каратеодори принципі бұған жоқ деп жауап береді. Жылу жүйенің күй функциясы болмағанымен, жүйеге жылу бергенде оның әсерінен күй функциясы - энтропия өзгереді, ал оны алғашқы күйге келтіру үшін міндетті түрде жылу керек, адиабаталық процесс арқылы бұл орындалмайды, себебі  Q=Q.
Q=Q.
Энтропияның жоғарыда айтылған қасиеттерімен қатар тағы бір маңызы оның процестің өту мүмкіндігі және бағытын көрсететін функция екендігінде.
Қайтымды процестің жұмысы максимал болса, қайтымсыз про-цесте жұмыстың бір бөлігі жоғалады, ол жалпы мүмкін болатын максимал жұмыс пен нақты өндірілген жұмыстың айырымына тең болады. Изотермиялық жағдайдағы бұл айырымның мәнін есептеуге болады. Жоғарыдағы келтірілген теңсіздікті TdS>  Q төменгі теңдік арқылы жазайық:
Q төменгі теңдік арқылы жазайық:
TdS=  Q+
Q+  Q* (IV.28)
Q* (IV.28)
Бұл жерде  Q* - оң таңбалы шама. Изотермиялық жағдайда (ІV.28)-теңдеуді интегралдауға болады, сонда:
Q* - оң таңбалы шама. Изотермиялық жағдайда (ІV.28)-теңдеуді интегралдауға болады, сонда:
T(S2-S1)=Q+Q* (ІV.29)
Жүйеге берілген жылуды осыдан есептесек:
Q=T(S2-S1)-Q* (IV.30)
T(S2—S1) өрнекті-Клаузцус компепсацияланған жылу деп атап, ал Q*-ді изотермиялық процестегі компенсацияланбаған жылу деді. Компенсацияланған жылудың мәні нольден кіші де болуы мүмкін, ол энтропияның бастапқы және соңғы күйдегі мәндеріне байланысты. Компенсацияланбаған жылуды Q* алатын болсақ, ол үнемі нольден үлкен болады, қайтымды процестерде ол нольге айналады.
Жүйе жұмыс істейтін жағдайда бірінші заң оның мәнін мына тендеу арқылы табады:
A=Q-(U2-U1) (IV.31)
(ІV.32) - теңдеуді (IV.31)-тендеуге қойсақ:
A=(U1-TS1)-(U2-TS2)-Q* (IV.32)
(IV.24) – тендеудегі максимал жұмыстың мәнін біле тұра
(IV.32) -тендеуден:
A-Amax=-Q*<0 (IV.33)
Қайтымсыз процестегі жоғалатын жұмыстың мәні компенсацияланбаған жылуға тең.
Жүйеге жұмыс жұмсалатын болса, онда қайтымды процеспен салыстырғанда қайтымсыз процесте артық жұмыс жұмсалады. Жоғарыдай есептер жүргізегін болсақ:
А—Ақайтымды =Q* > 0 (IV.34)
Бұнда A - сырттан жұмсалған жұмыс, ал Q* мәнін кайтымсыз процестерде табу киын, Q*>0 деп жазған жеткілікті, қайтымды. процестерде Q*=0.
Жоғарыда энтропияның жалпы өзгерісі қоршаған ортамен жылу
ауысу мен және жүйенің өзіндегі қайтымсыз процестер өтуімен байланысты дедік. Сонда
dS=dSe+dSi (I.V.35)
Жүйені оқшаулау үшін жылу көзін жүнен кіргізу керек. Қайтымды процестер үшін dSі=0, сонда оқшауланған жүйеде энтропияның өсуі жүйедегі қайтымсыз процестердің өту белгісі болды. Оқшауланған жүйедегі қайтымсыз процестер міндетті түрде өздігінен өтеді. Сөйтіп (ІV.21)-тендеу ироцестің өту шарты болып табылады. Егерде 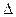 S <0 болса, онда оқшауланған жүйеде процесс өздігінен өтпейді. Өздігінен өтетін процестің нәтижесінде жүйе тепе-теңдікке ұмтылады. Жүйе тепе-теңдікке келгенде процестер тоқтап, энтропия өзінің максимал мәніне ие болады. Сөйтіп, оқшауланған жүйенің тепе-теңдік күйде дегеніміз энтропия мәні максималға жетіп, одан әрі өзгермеуі болып табылады.
S <0 болса, онда оқшауланған жүйеде процесс өздігінен өтпейді. Өздігінен өтетін процестің нәтижесінде жүйе тепе-теңдікке ұмтылады. Жүйе тепе-теңдікке келгенде процестер тоқтап, энтропия өзінің максимал мәніне ие болады. Сөйтіп, оқшауланған жүйенің тепе-теңдік күйде дегеніміз энтропия мәні максималға жетіп, одан әрі өзгермеуі болып табылады.
Егер жүйе айналадағы ортамен жылу не жұмыс алмасу арқылы әсерлесетін болса, онда өтетін процестердің нәтижесінде энтропия өсуі де, кемуі де мүмкін. Сондықтан процестің өту мүмкіндігі мен онын бағыты туралы мәліметтер алу үшін барлық қатысатын денелерді жүйеге кіргізу керек (оның ішінде жылу көзі де>, яғни жүйені оқшауланған күйде алу қажет.
