Одиночные и кратные связи. Сигма- и пи- связи.
Одиночная связь – ковалентная связь, при которой между двумя атомами образуется только одна общая электронная пара.
Сигма-связь – ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей ядра атомов. Одинарные связи всегда являются сигма-связями.
Пи-связь – ковалентная связь, при образовании которой область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра. Образуются в тех случаях, когда между двумя атомами возникают две или три общие электронные пары. Число общих электронных пар между связанными атомами характеризует кратность связи.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной сигма-связи и одной пи-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной сигма-связи и двух пи-связей.
Двойные и тройные связи имеют общее название: кратные связи.
Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи. В результате этого между атомами возникают кратные связи: Одинарная (σ), Двойная (σ +π), Тройная (σ + π + π) .F−F, O=O, N≡N.
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи - δ-связи: Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d- и f-орбиталей путем перекрывания их "лепестков" сразу в четырех местах. В результате кратность связи может возрасти до 4-5.
Основные типы структур неорганических соединений. Вещества с молекулярной и
немолекулярной структурой. Атомные, молекулярные, ионные и металлические
кристаллические решетки.
| Тип | молекулярная | ионная | атомная | металлическая |
| В узлах | молекулы | Положительно и отрицательно заряженные ионы (катионы и анионы) | Атомы | Атомы и положительно заряженные ионы металлов |
| Хар-тер связи | Силы межмолекулярного взаимодействия ( в т.ч. водородные связи) | Электростатические ионные связи | Ковалентные связи | Металлическая связь между ионами металлов и свободными электронами. |
| Прочн | Слабая | Прочная | Очень прочная | Разной прочности |
| Отл. Физ. Св-ва | Легкоплавкие, небольшой твердости, многие растворимы в воде. | Тугоплавкие, твердые, многие растворимы в воде, растворы и расплавы проводят электрический ток (проводники 2 рода) | Очень тугоплавкие, очень твердые, практически нерасворимы в воде | Разнообразны по свойствам: имеют блеск, обладают электропроводностью (проводники 1 рода) и теплопроводностью. |
| прим | Йод, лёд, «сухой лед». | NaCl, KOH, Ba(NO3)2 | Алмаз, кремний | Медь, калий, цинк. |
Молекулярные и немолекулярные вещества — один из признаков химических веществ относительно их строения.
Молекулярные вещества — это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства. Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Существуют вещества с молекулярным и немолекулярным строением. Молекулярное строение имеют все газы, все жидкости. Твердые вещества могут иметь молекулярное и немолекулярное строение. Молекулярное строение имеют летущие твердые вещества (лед, иод, белый фосфор, органические вещества). В узлах кристаллической решетки легколетучих твердых веществ находятся молекулы. Большинство неорганических твердых веществ имеют немолекулярное строение, в узлах решеток находятся ионы (соли, основания) или атомы (металлы, алмаз, кремний). Вещества с молекулярным строением составляют более 95% от всех известных веществ, так как органические вещества имеют молекулярное строение, а органических веществ известно гораздо больше, чем неорганических.
Химические реакции. Классификация химических реакций. Основные задачи химической кинетики и химической термодинамики.
Химические реакции–это явления, при которых происходит превращение одних веществ в другие.
Признаки химических реакций:
ü Выделение газа
Na2CO3+2HCl=2NaCl+H2O+CO2 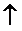
ü Выпадение или растворение осадка
BaCl2+H2SO4=BaSO4 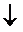 +2HCl
+2HCl
ü Изменение цвета
FeCl3(желтый)+3KSCN(бесцветный)=Fe(SCN)3(красный)+3KCl
ü Появление запаха.
ü Излучение света и тепла
H2SO4+2NaOH=Na2SO4+2H2O+Q
2Mg+O2=2MgO+hv
Для протекания химических реакций необходимы условия: соприкосновения реагирующих веществ, нагревание, освещение.
Классификации химических реакций:
I. По числу и составу исходных реагентов:
a) Реакция соединения – реакция, при которой из нескольких веществ образуется одно вещество, более сложное, чем исходные: А+В=АВ
SO3+H2O=H2SO4
S+O2=SO2
NH3+HCl=NH4Cl
b) Реакция разложения – реакция, при которой из одного сложного вещества образуется несколько веществ. Конечными продуктами могут быть как простые, так и сложные вещества: АВ=А+В
2HgO=2Hg+O2
2KClO3=2KCl+3O2
c) Реакция замещения – реакция, при которых атомы адного элемента замещают атомы другого элемента в сложном веществе и при этом образуются два новых – простое и сложное: Х+АВ=АХ+В
Fe+CuSO4=FeSO4+Cu
Zn+2HCl=ZnCl2+H2
d) Реакция обмена – реакция, при которой реагирующие вещества обмениваются своими составными частями, в результате чего из двух сложных веществ образуются два новых сложных вещества: АВ+СХ=АХ+СВ
BaCl2+Na2SO4=2NaCl+BaSO4
AgNO3+HCl=HNO3+AgCl
II. По знаку теплового эффекта реакции делятся на:
a) эндотермические — реакции, протекающие с поглощением тепла
b) экзотермические— реакции, в результате которых тепло выделяется.
III. С учетом явления катализа:
a) каталитическими (протекающие с участием катализатора)
b) некаталитическими.
IV. По признаку обратимости реакции делят на:
a) обратимые – протекающие одновременно в пярмом и обратном направлении
b) необратимые – протекающие толкьов одном направлении
V. По признаку изменений степеней окисления элементов в молекулах реагирующих веществ:
a) ОВР – реакции с переносом электронов
b) Не ОВР – реакции без переноса электронов.
VI. По признаку однородности реакционной системы:
a) Гомогенные – протекающие в однородной системе
b) Гетерогенные – протекающие в неоднородной системе
