Физическая теория растворов (Вант-Гофф).
Растворитель является индифферентной средой, в которой равномерно размешаны молекулы растворенного вещества по всему объему раствора. Взаимодействия между чатицами и молекулами нет. Теория оправдывается для разбавленных растворов неэлектролитов.
Химическая теория растворов (Менделеев).
Растворитель дает с растворенным веществом определенные соединения – сольваты.
Молекулы сольватов образуют с растворителем молекулярную смесь.
Причина образования сольватов – проявление донорно-акцепторных и водородных связей. Вокруг ионов располагаются молекулы растворителя, образуя сольватные слои (оболочки).
Сольваты менее прочны, чем обычные химические соединения. Легко разрушаются даже при небольшом повышении температуры растворов.
Растворение сопровождается выделением/поглощением теплоты, сокращением/увеличением объема.
Теплота растворения вещества – количество теплоты, поглощаемой (выделяемой) при растворении одного моля вещества.
Растворимость твердых веществ в жидкостях.
Зависит от природы твердых тел, природы растворителя и температуры.
С повышением температуры, как правило, растворимость увеличивается (так как теплоты растворения имеют отрицательные значения).
Для идеальных растворов справедливо уравнение Шредера: 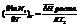 N1 – растворимость твердого вещества,
N1 – растворимость твердого вещества, 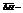 энтальпия растворения 1 моля вещества в насыщенном растворе.
энтальпия растворения 1 моля вещества в насыщенном растворе.
Растворение твердого вещества можно представить в две стадии: плавление вещества и смешение жидкого вещества с раствором. Тогда энтальпия смешения равна нулю, 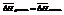
Идеальная растворимость увеличивается с повышением температуры (такие системы немногочисленны).
Давление мало влияет на растворимость твердых веществ.
При понижении температуры происходит выпадение вещества в осадок – процесс кристаллизации.
Растворимость жидкостей в жидкостях.
Растворимость увеличивается с повышением температуры и почти не зависит от давления.
Существуют неограниченная растворимость и растворимость до известного предела.
1. жидкости смешиваются в любых пропорциях (спирт и вода).
2. имеет место расслаивание (образование двух слоев – верхний и нижний). пример: эфир и вода.
Расслаивание уменьшается с ростом температуры и исчезает при некоторой (критической) температуре.
Законы Рауля.
Особенность растворов: давление пара растворителя над раствором ниже, чем над чистым растворителем.
Первый закон.
Давление пара растворителя над раствором пропорционально мольной доле растворителя в растворе.
Или
Относительно понижение давление пара растворителя над раствором равно мольной доли растворенного вещества.
Введем обозначения:
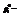 давление пара растворителя над чистым растворителем;
давление пара растворителя над чистым растворителем;
 давление пара растворителя над раствором;
давление пара растворителя над раствором;
 абсолютное понижение давления;
абсолютное понижение давления;
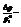 относительное понижение давления.
относительное понижение давления.


Если система полностью подчиняется закону, на графике наблюдаются прямолинейные зависимости. Однако в реальных системах наблюдаются отклонения.
Примечание автора. Обязательна графическая иллюстрация.

Температура замерзания раствора ниже температуры замерзания чистого растворителя, а температура кипения – выше.
Второй закон.
Повышение температуры кипения раствора и понижение температуры его замерзания пропорциональны моляльной концентрации раствора.
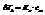
 К – константа, характеризующая растворитель.
К – константа, характеризующая растворитель.
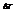 не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
С помощью законов Рауля можно определять неизвестные молекулярные массы растворенных веществ.
