Определение свободной углекислоты в воде
Посуда Реактивы
Конические колбы объёмом 200 мл, едкий натрий 0,1 N
Колбы с меткой 100-150 мл - 4 шт., фенолфталеин 1%
Мерный цилиндр на 200 мл, соляная кислота 0,1 N
Пипетки 1-2,25-50 мл метилоранжевый 0,1 %
Ход анализа
Способ определения свободной углекислоты сводится к следующему. Исследуемую воду, в которую добавлен фенолфталеин, титруют раствором щелочи определенной концентрации. Пока вся свободная углекислота не будет нейтрализована щелочью, раствор остается бесцветным. Как только свободная углекислота перейдет в бикарбонатную, раствор окрасится в розовый, а при дальнейшем прибавлении щелочи – в красный цвет. Реакция связывания свободной углекислоты протекает по следующей схеме
CO2 + H2O H2CO3
H2CO3 + NaOH H2O + Na HCO3
Если вместо свободной углекислоты в воде присутствует монокарбонатная углекислота, то вода окрашивается в розовый цвет сразу после добавления фенолфталеина. В этом случае титруют не щелочью, а кислотой до тех пор, пока окраска жидкости не ослабеет до бледнорозовой, т.е. монокарбонатная углекислота не перейдет в бикарбонатную:
2CaCO3 + 2HCl Ca(HCO3)2 + CaCl2 .
В колбу с меткой 150 мл наливают исследуемую воду, предварительно несколько раз ополоснув её. Затем добавляют 0,1 мл раствора фенолфталеина и титруют раствором едкого натрия. Количество свободной углекислоты вычисляется по формуле:
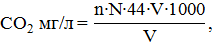
где n – число мл едкого натрия, пошедшего на титрование, N – нормальность едкого натрия, V – объем титровавшейся жидкости.
Количество растворенной в воде углекислоты зависит от ее температуры (табл. 5) и рассчитывается аналогично по формуле насыщения кислорода.
Таблица 5. Растворимость двуокиси углерода в дисциллированной воде для влажной атмосферы в пересчете на единицу объема сухих компонентов
воздуха на уровне моря, по Хатчинсону Д.
| Температура, ˚С | Содержание двуокиси углерода, % | ||
| 0,03 | 0,033 | 0,044 | |
| 1,00 | 1,10 | 1,47 | |
| 0,96 | 1,06 | 1,41 | |
| 0,93 | 1,02 | 1,36 | |
| 0,89 | 0,99 | 1,30 | |
| 0,86 | 0,94 | 1,26 | |
| 0,83 | 0,91 | 1,22 | |
| 0,80 | 0,88 | 1,17 | |
| 0,78 | 0,86 | 1,14 | |
| 0,75 | 0,82 | 1,10 | |
| 0,72 | 0,79 | 1,06 | |
| 0,70 | 0,76 | 1,02 | |
| 0,67 | 0,74 | 0,98 | |
| 0,65 | 0,72 | 0,95 | |
| 0,63 | 0,69 | 0,92 | |
| 0,61 | 0,67 | 0,89 | |
| 0,59 | 0,65 | 0,87 | |
| 0,57 | 0,62 | 0,84 | |
| 0,55 | 0,60 | 0,81 | |
| 0,54 | 0,59 | 0,79 | |
| 0,52 | 0,58 | 0,76 | |
| 0,51 | 0,56 | 0,74 | |
| 0,49 | 0,54 | 0,72 | |
| 0,48 | 0,52 | 0,70 | |
| 0,46 | 0,51 | 0,68 | |
| 0,45 | 0,50 | 0,66 | |
| 0,44 | 0,48 | 0,64 | |
| 0,42 | 0,46 | 0,62 | |
| 0,41 | 0,45 | 0,60 | |
| 0,40 | 0,44 | 0,59 | |
| 0,39 | 0,43 | 0,57 | |
| 0,38 | 0,42 | 0,56 |
Определение перманганатной окисляемости воды
Посуда Реактивы
Колбы конические – 4 шт., серная кислота 25 %
Мерный цилиндр, марганцовокислый калий 0,01 N
Пипетки 5,10 мл щавелевая кислота 0,01 N
Ход анализа
Окисляемость воды является косвенным показателем загруженности воды органическими веществами и выражается количеством мг кислорода, идущего на разрушение части органических веществ, заключенных в 1л исследуемой воды в строго определенных условиях. При определении окисляемости разрушается около 30 % всех органических веществ. Определение окисляемости натуральной не фильтрованной воды дает представление как о растворенном, так и взвешенном органическом веществе. Определение же окисляемости фильтрованной воды – только о растворенном.
Окисляемость принято определять методом, основанным на способности марганцовокислого калия окислять органические вещества, отдавая им свой кислород. Окисление в кислой среде, которое особенно энергично протекает при прогревании, приводит к восстановлению марганца до двухвалентного иона:
2KMnO4 + 3H2SO4 K2SO4* + 2MnSO4 + 3H2O + 5O2−
* - идет на окисление органических веществ.
Марганцовокислый калий добавляется к исследуемой воде в избытке, избыток которого разрушается строго определенным количеством щавелевой кислоты. Количество щавелевой кислоты, оставшейся после восстановления избыточного марганцовокислого калия, определяется титрованием новой порции KMnO4. В конечном счете, чем больше марганцовокислого калия пошло на последнее титрование, тем больше кислорода израсходовалось на окисление органических веществ исследуемой воды. На этом основаны расчеты. Условность определения окисляемости заставляет требовать строгого соблюдения единообразия приемов анализа, в частности, точного десятиминутного кипячения исследуемой воды.
В колбу емкостью 200-300 мл отмерить 100 мл перемешанной исследуемой воды, добавить в нее пипеткой 5 мл 25 % серной кислоты и нагреть на ровном пламени. Как только жидкость закипит, колбу снимают и приливают в нее пипеткой 10 мл 0,01N раствора KMnO4 и снова ставят на нагревательный прибор, поддерживая слабое равномерное кипение жидкости точно 10 минут, считая с момента закипания после прибавления реактива. Для равномерного кипения колба закрывается пробкой. Если во время кипения жидкость совершенно обесцветится или вместо розовой станет светло – бурой, определения повторяют, разбавив исследуемую воду дистиллированной.
Если после кипячения жидкость не обесцветится, то колбу снимают и сразу добавляют 10 или 0,01 N раствора щавелевой кислоты. Жидкость размешивают, после чего она обесцвечивается. Обесцвеченную горячую жидкость титруют при энергичном помешивании. Для титрования используют 0,01 N раствора KMnO4. Титрование продолжают до появления устойчивости, но очень слабой розовой окраски. Сразу после этого приступают к установки титра раствора марганцовокислого калия, для чего в жидкость добавляют 10 мл 0,01 N раствора щавелевой и снова титруют KMnO4 до появления точно такой же слабой розовой окраски. Результаты анализа рассчитывают следующим образом::

где А – число мл 0,01 N раствора KMnO4, пошедшего на титрование избытка щавелевой кислоты, с – число мл 0,01 N раствора KMnO4, пошедшего на титрование для установления титра, V – объем испытуемой воды, N – нормальность раствора.
Все полученные в ходе титрования данные по определению кислорода и диоксида углерода заносятся в соответствующие таблицы полевого дневника. Затем результаты по концентрации кислорода и диоксида углерода пересчитываются на температуру воды водоема при взятии проб по приведенным формулам и таблицам Г.Г. Винберга (табл. 4) и Д. Хадчинсона (табл. 5). Температурная поправка по данным окисляемости НЕ рассчитывается.
Полученные Вами результаты составляют базу обсуждения и сравнения с данными других авторов, работавших в этой области. Если Вы выяснили, что Ваши работы оказываются повторением, то в этом случае Ваши результаты могут рассматриваться как мониторинговые и требуют выяснения возможных причин современного состояния водного объекта, что крайне важно. В случае первичности проведенной Вами работы полученные данные должны быть Вами проанализированы, по возможности объяснены или Вами выдвигается предположение (гипотеза) для объяснения. Полученные результаты могут быть проверены в течение следующего сезона или в лабораторном эксперименте, а также послужить отправной точкой для последующих мониторинговых исследований. В нашей области достаточно слабо изученных водных объектов, которые ждут Вас – пытливых исследователей. В добрый путь!
Рекомендуемый библиографический список
1. Алекин О.А. Основы гидрохимии. – Л.: Гидрометиздат, 1970. – 444 с.
2. Баканина Ф.М., Воротников В.П., Лукина Е.В., Фридман Б.И. Озера Нижегородской области. – Н.Новгород: ВООП, 2001. – 165 с.
3. Бакка С.В., Киселёва Н.Ю. Особо охраняемые природные территории Нижегородской области. – Н. Новгород: Минприроды Ниж. обл., 2008. - 560 с.
4. Богословский Б.Б. Озероведение. – М.: МГУ, 1960. – 325 с.
5. Доманицкий А.П., Дубровина Р.Г., Исаева А.И. Реки и озера Советского Союза. – Л.: Гидрометиздат, 1971. - 103 с.
6. Жизнь пресных вод СССР. Под ред. Жадина В.И. В 4-х т. - М.-Л.: АН СССР.
7. Константинов А.С. Общая гидробиология. – М.: Высшая школа, 1986. – 471 с.
8. Природа Горьковской области. Под ред. Н.В. Кузнецова. – Горький: Вол-го-Вятское кн. изд-во, 1974. – 416 с.
9. Станковская Т.П. К вопросу комплексного использования малых озер. / Вестник НГСХА - Н.Новгород: НГСХА, 2014, с. 270 -274. . (сайт НГСХА).
10. Станковская Т.П. Экологические основы рыбоводства. – Н.Новгород: НГСХА, 2005. – 169 с. (сайт и библиотека НГСХА).
11. Станковская Т.П. Гидробиологические основы прудово-озерного рыбоводства. – Н.Новгород: НГСХА, 2014. – 283 с. (библиотека НГСХА).
12. Унифицированные методы исследования качества вод. – М.: СЭВ, 1983. Часть III. Методы биологического анализа вод, с. 82-91, с. 250-265, с. 323-329.
13. Харитонычев А.Т. Физическая география Горьковской области.- Горький: ГГПИ, 1985. - 96 с.
Примечание:
- указанные издания могут быть представлены в Областной библиотеке имени В.И. Ленина, в Интернет, где помимо них можно найти и другие источники, а также карты, атлас Нижегородской области, сведения об отдельных водных объектах области и т.п.;
- в ходе оформления работы при использовании материалов Интернета указывать в библиографическом списке адрес сайта, информацией которого Вы пользовались.
